最新!2025 医保国谈初审名单公布


独家抢先看
8 月 12 日,国家医保局公示了《通过 2025 年国家基本医疗保险、生育保险和工伤保险药品目录及商保创新药目录调整初步形式审查的申报药品名单》,公示时间为 8 月 12 日~8 月 18 日。
来源:医保局官网
根据医保局发布的文件,本次通过基本目录形式审查的目录外药品有 247 个独家品种和 63 个非独家品种。同时,今年目录调整中增设了商保创新药目录,与基本医保目录同步申报。
国内外大药企或是商保谈判主力
商保创新药目录是对基本目录的补充,主要纳入的就是创新程度高、具有显著临床,但超出保基本定位的创新药。
根据规则,2020 年 1 月 1 日至 2025 年 6 月 30 日期间,在国内获批上市的新通用名独家药品,或者是 2025 年 6 月 30 日前经国家药监部门批准上市的罕见病独家药品,可以单独申报商保创新药目录,或同时申报商保创新药目录、基本目录。
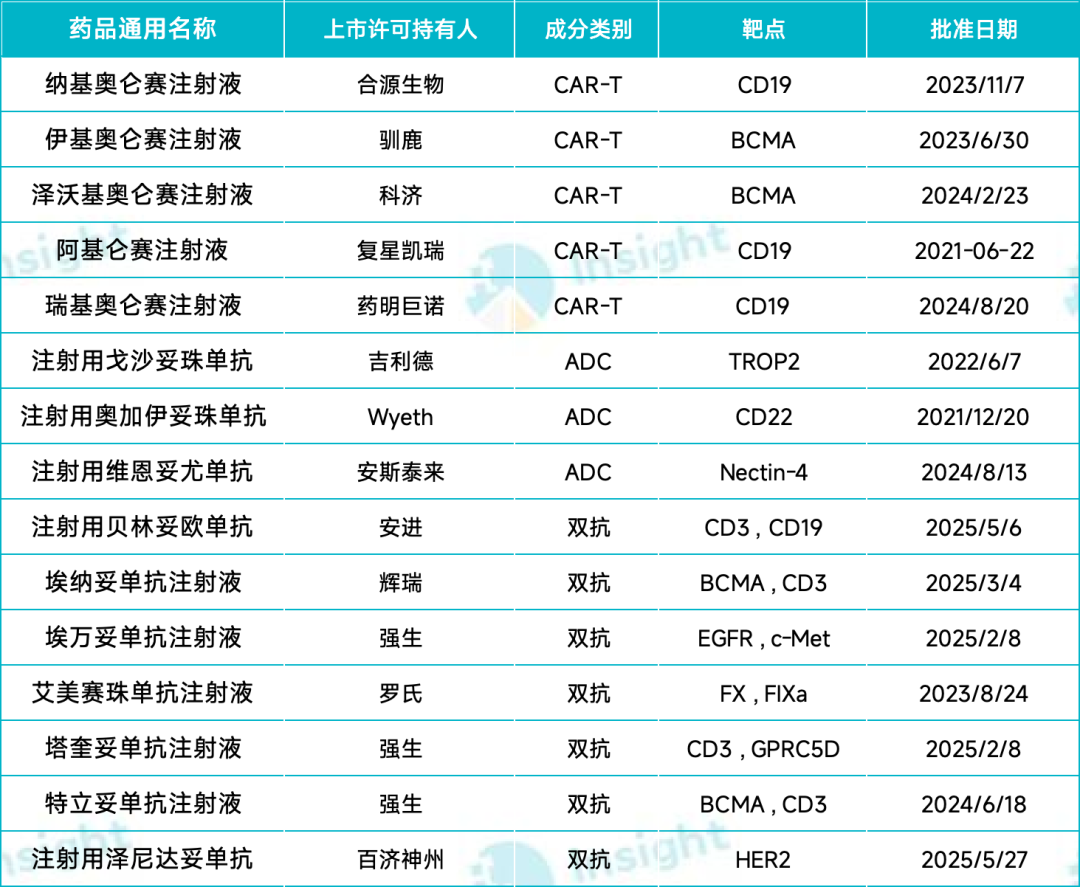
本次商保创新药目录中,通过初步形式审查的目录外产品有 121 款。其中有 79 款同时通过了基本目录和商保目录的形式审查,包括 12 款单抗、3 款 CAR-T 疗法、1 款 ADC、1 款双抗、2 款中成药等。这些同时通过两个目录形式审查的产品,从流程上会先开展基本目录谈判,失败的再和商保协商价格。
同时通过基本和商保目录形式审查的 2025 年上市新药
来源:Insight 数据库整理(注:企业以上市持有人为准,下同)
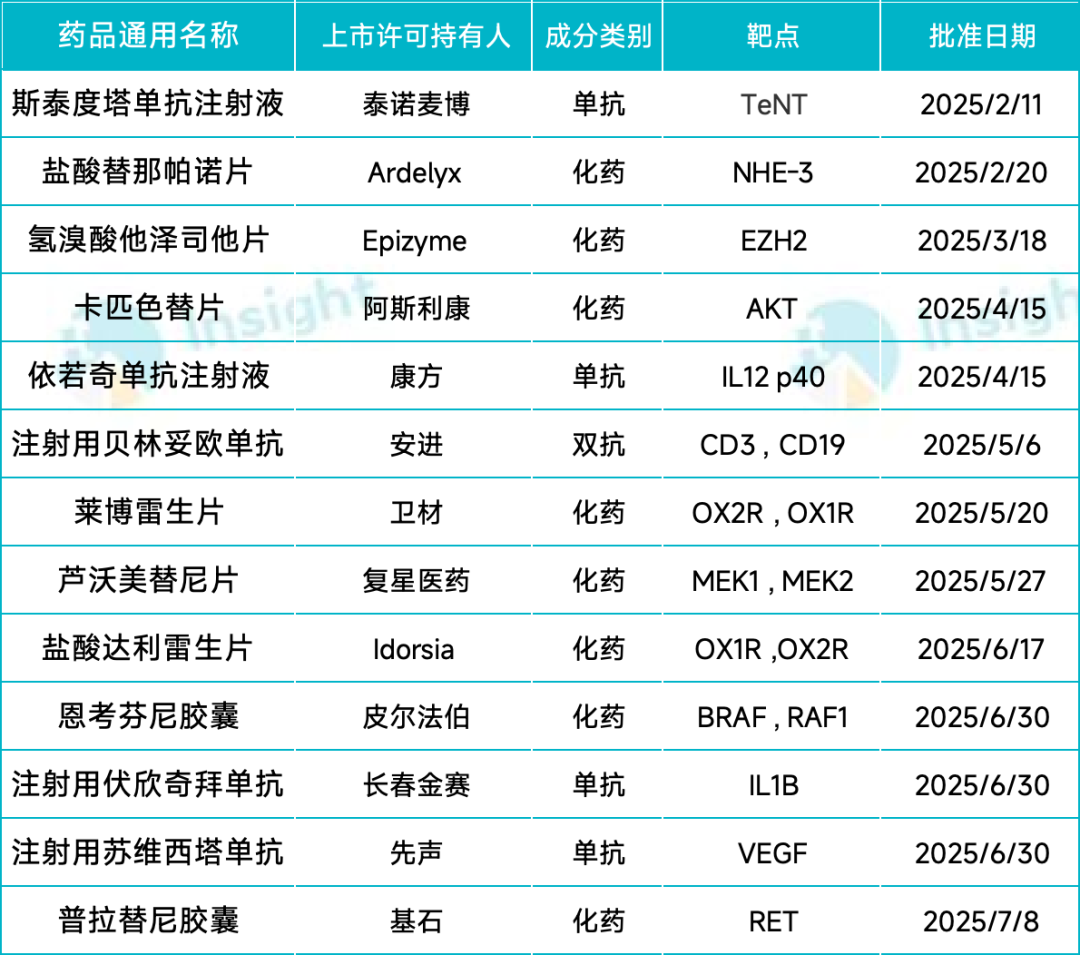
另外,有 42 款目录外药品仅通过了商保目录的初步形式审查,其中绝大多数产品来自国内外大药企,包括强生的三款双抗(特立妥单抗、塔奎妥单抗和埃万妥单抗)、诺和诺德的司美格鲁肽片、百济的泽尼达妥单抗等。
值得注意的是,国内一共有 7 款 CAR-T 产品获批上市,其中 5 款申报了商保创新药目录,雷尼基奥仑赛(恒润达生,2025 年 7 月 29 日上市)和西达基奥仑赛(传奇生物,2024 年 8 月 20 日上市)未参与今年商保谈判。
来源:Insight 数据库整理
ADC 和双抗也是今年商保目录谈判的主力。这主要是因为商保给创新药留了很大空间。商保将通过协商定价而不是谈判降价的模式,确定目录内药品的结算价。而且,这些纳入商保目录的产品,将不计入医院药占比考核,也不纳入 DRG/DIP 病种付费,不参与集采替代监测。
基本目录谈判进一步加剧
除了商保目录之外,基本目录也值得关注。本次目录外申报信息 472 份,涉及药品通用名 393 个,通过初审的通用名 310 个,较 2024 年 249 个通过形式审查明显增加。
以下 Insight 数据库将介绍通过初审的目录外品种中部分备受关注的新药信息,仅供参阅。
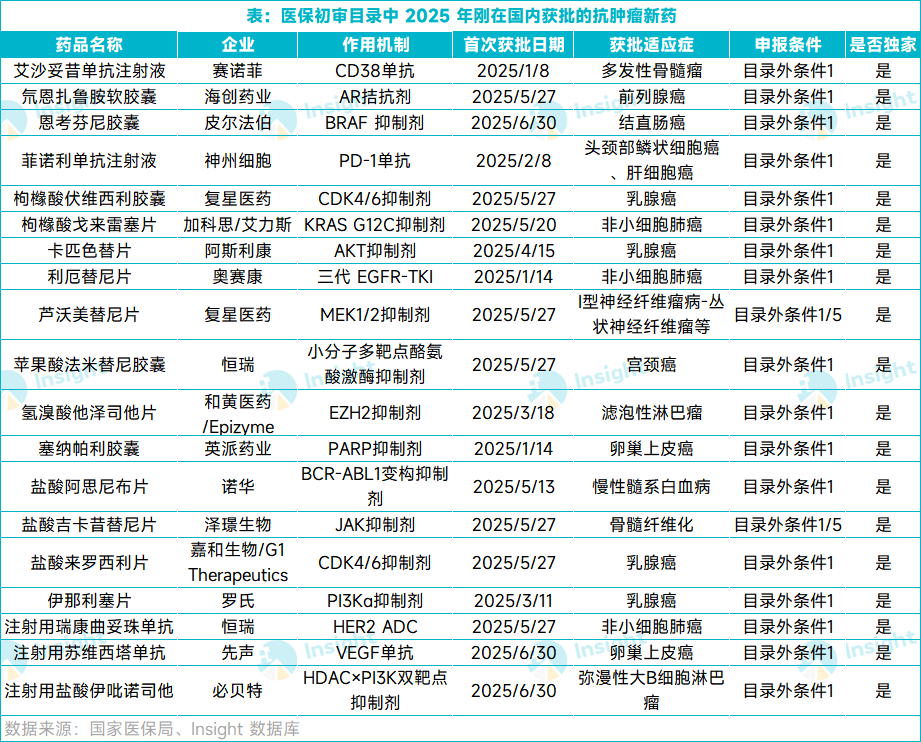
今年刚获批, 19 款独家肿瘤新药被纳入
根据名单,有 19 款今年上半年首次在国内获批的抗肿瘤新药也通过了形式审查(详见下表),药物类型包括多款小分子抑制剂,以及 CD38 单抗、CD3×CD19 双抗、HER2 ADC 等生物新药,适应症涵盖多发性骨髓瘤、前列腺癌、非小细胞肺癌、乳腺癌等等多个癌症类型。
这些药物中包括不少具有「首个」意义的突破性重磅药物,其中包括:
阿斯利康的卡匹色替获批治疗 HR 阳性、HER2 阴性乳腺癌,是国内首个获批的 AKT 抑制剂。
和黄医药从益普生旗下 Epizyme 引进的他泽司他获批治疗复发或难治性滤泡性淋巴瘤,是国内首个获批的 EZH2 抑制剂;
诺华的阿思尼布是全球首个基于 ABL 肉豆蔻酰口袋(STAMP)创新机制的靶向药物,通过改变蛋白构象以实现对靶蛋白的抑制,获批用于治疗新诊断的费城染色体阳性的慢性髓细胞白血病慢性期成人患者。
罗氏的伊那利塞是中国首个获批的第三代高选择性 PI3Kα抑制剂,也是中国首个针对 PIK3CA 突变的靶向创新药物。
必贝特医药的伊吡诺司他是全球首个获批的 PI3K/HDAC 双靶点抑制剂,获批用于治疗弥漫性大 B 细胞淋巴瘤。
双抗
截图来源:Insight 数据库整理
作为全球首个对复发/难治弥漫大 B 细胞淋巴瘤(R/R DLBCL)患者进行固定周期治疗的双特异性抗体,格菲妥单抗于 2023 年在中国获批单药用于治疗既往接受过至少两线系统性治疗的 R/R DLBCL 成人患者。
2025 年 5 月,该药新适应症获 NMPA 批准上市,联合吉西他滨与奥沙利铂(GemOx)用于治疗不适合自体造血干细胞移植(ASCT)的 R/R DLBCL 非特指型成人患者(2L+ DLBCL)。
贝林妥欧单抗于 2020 年 11 月获 NMPA 批准,用于治疗成人复发或难治性前体 B 细胞急性淋巴细胞白血病,成为全球首个获批的靶向 CD19 和 CD3 的细胞衔接分子(BiTE)。该药由安进开发,百济神州根据此前达成的全球肿瘤战略合作获得其在中国的授权。
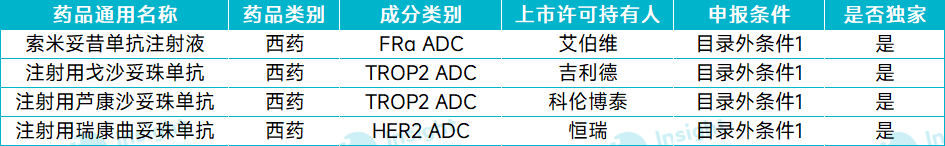
ADC
截图来源:Insight 数据库整理
索米妥昔单抗为中美华东与 ImmunoGen(已被艾伯维收购)合作开发的针对叶酸受体 α(FRα)靶点的全球首创 ADC 药物,于 24 年 11 月获得 NMPA 批准上市,用于既往接受过 1-3 线系统性治疗的 FRα 阳性的铂类耐药卵巢癌。
吉利德的戈沙妥珠单抗于 2022 年 6 月获 NMPA 批准上市,适应症用于既往至少接受过 2 种系统治疗的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。戈沙妥珠单抗是全球首个靶向 Trop-2 的 ADC 药物。在 2023 年和 2024 年的医保谈判中,注射用戈沙妥珠单抗被列入谈判名单,但是最终没能进入医保目录。
芦康沙妥珠单抗是科伦博泰研发的 TROP2 ADC,在国内已获 NMPA 批准两项适应症:2024 年 11 月,获批用于既往至少接受过 2 种系统治疗的不可切除的局部晚期或转移性三阴性乳腺癌成人患者;2025 年 3 月,获批用于治疗经 EGFR-TKI 和含铂化疗治疗失败的局部晚期或转移性 EGFR 突变的 NSCLC 患者。
恒瑞的瑞康曲妥珠单抗于 2025 年 5 月获 NMPA 批准上市,单药适用于治疗存在 HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。同时,该药也是恒瑞首款商业化的 ADC 产品。
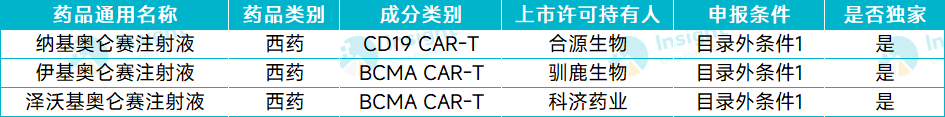
CAR-T
截图来源:Insight 数据库整理
合源生物的 CD19 靶向 CAR-T 纳基奥仑赛注射液于 2023 年 11 月 07 日获得 NMPA 批准,用于治疗成人复发或难治性 B 细胞急性淋巴细胞白血病。
伊基奥仑赛注射液由信达生物和驯鹿生物联合开发,于 23 年 6 月获 NMPA 批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少 3 线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
科济药业的 BCMA 靶向 CAR-T 泽沃基奥仑赛注射液于 2024 年 2 月 23 日获 NMPA 批准上市,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少 3 线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”