罕见病药物在国内上市比国外滞后10年 药监局已经绿灯全开


独家抢先看
2021年,父亲制药救子、母亲代购救儿药被认定“贩毒”的事件接连发生。在黑色幽默般的人间荒诞背后,是遗憾的事实:
只有5%的罕见病有药可治,即使成为5%中的一员,一些中国患者也只能望药兴叹,因为很多药尚未在国内上市,一些罕见病药物在国内上市比国外滞后10年。
为了活命,许多罕见病患者只能选择海外淘药,很多患者因此被骗,家庭经济雪上加霜。
如果说罕见病是一种遗传魔咒,支持药品研发上市的政策,就是打破魔咒的关键。
药企的难题
2012年,第一届中国罕见病高峰论坛召开时,几乎没有国内企业的身影,参加会议的外资药企也屈指可数,仅有拜耳、健赞等企业。
近10年来,中国创新药物层出不穷,为什么罕见病用药还是那么少?
担心研发收不回成本只是其中一个方面。山东省医学科学院院长、山东省罕见疾病防治协会会长韩金祥的看法是:一般认为患者人数在30万到50万人时,一款药才有可能赚钱。而美国将患病人数小于20万的疾病称为罕见病,中国虽然尚未有官方认定的罕见病定义,但国内很多罕见病病种的患者人数不足10万人,甚至低于3万人,这意味着单个罕见病药品的市场太小。
另一个是,即使药企决定在中国布局罕见病药物,也面临着一系列的问题。
首先是药品获批时间漫长。2015年药审改革启动之前,药品从开始申报上市到最后拿到批件要历时18个月。同样的罕见病药物,澳大利亚这个过程是5天,美国、韩国则是1个月。
一位曾就职于美国FDA的研发人员对健识局表示:美国FDA有几千人在审批,国内的药品审批的专业人数太少,审批速度慢。2014年底时,药审中心专门做技术审评的审评员只有89人。
其次是研发难度和成本。一般来说,新药开发都遵循“双十定律”,10年时间研发,花费10亿美元。健识局在2021年中国生物医药产业创新大会上了解到,新药开发的成本逐年攀升,最高可达到26亿美元。罕见病由于患者人数少,临床试验组织十分困难,成本也就更高。
不少企业做了一个“聪明”的决定。一家罕见病企业的研发人员表示:罕见病当中8成比例是基因遗传病,有2成不到跟肿瘤有关。大部分开发“罕见病药物”的企业选择了针对肿瘤。
再就是市场保护的顾虑。一款罕见病药品成功过上市,也要面临被仿制的挑战。
其实,整体上看,罕见病药物开发的成功率超过其它创新药。
根据药明康德的研究,2011年至2020年,非肿瘤适应症的罕见病用药在美国开发并获批的成功率平均达到17%,高于药物的平均开发成功率7.9%。在罕见病药物的4个临床开发阶段,转化成功率也高于行业平均值。
罕见病多为遗传病,有明确治疗路径,这一点可以提高开发的成功率。此外,在开发罕见病适应症之后,药企还可以拓宽药物的适应症,扩大目标市场。
有罕见病企业在2017年对媒体总结到:虽然国家也一直在鼓励罕见病药物研发,但还远远不够,也缺乏具体实施的细则。
政策在转变
中国市面上的罕见病药物,主要是进口专利药和国内仿制药,国产原研还处于起步阶段。
2017年,国家计划出台《第一批罕见病目录》的消息传开了,市场意识到:可能会有相关药物审批的利好政策。因为,目录明确了哪些是罕见病,政策才能有的放矢地给予帮助和支持。
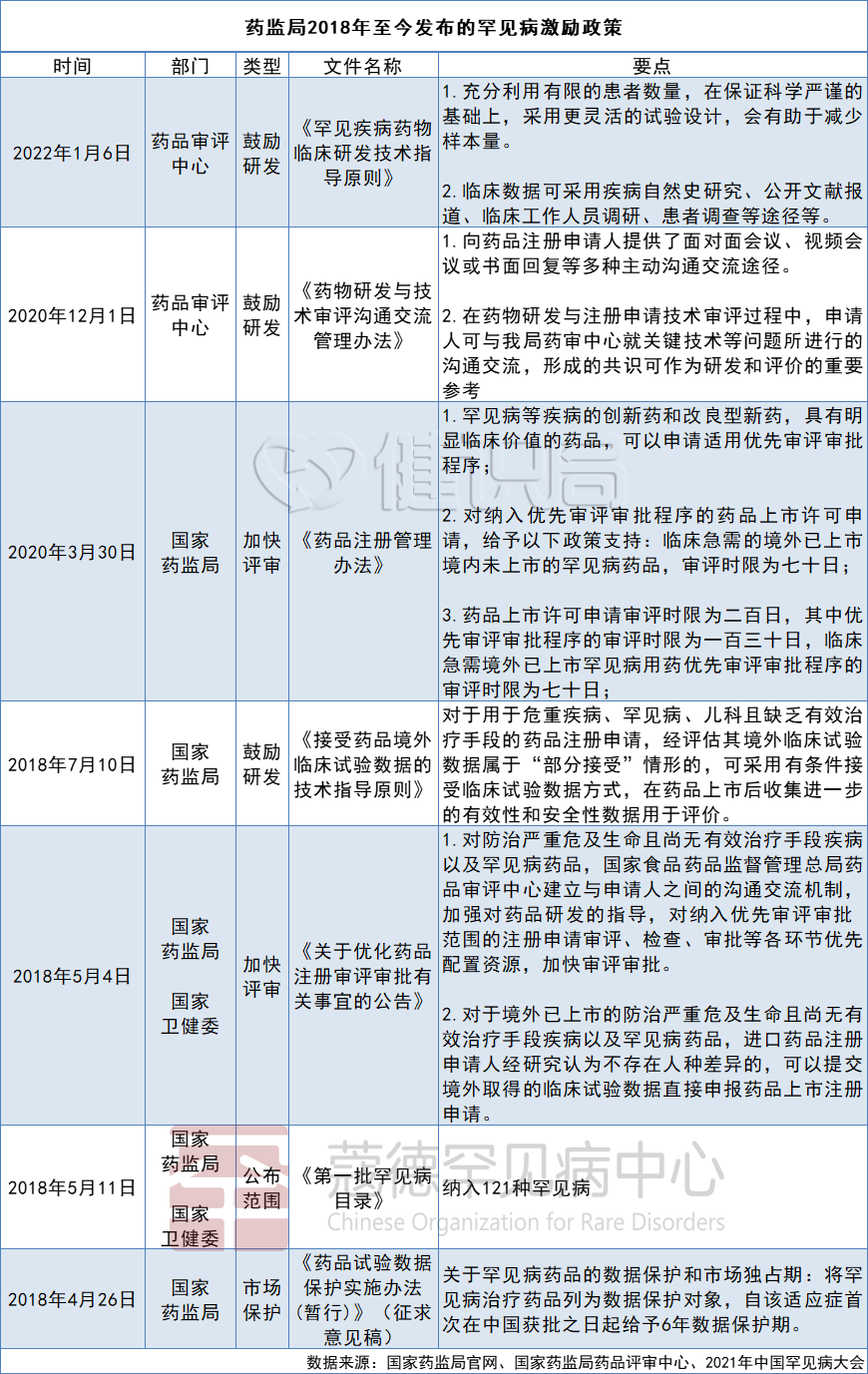
在2021年中国罕见病大会上,时任国家药监局药品注册司化药处处长的徐晓强总结:通过法规制度的建立,加快了罕见病新药上市的进程,这是药监局近年来的政绩之一。
《第一批罕见病目录》发布之后,国家药监局主要做了3大块工作:一是加快审评审批,降低企业的时间成本;二是帮助企业临床开发,减少企业的研发成本;三是对罕见病药品进行数据保护,保证上市后一定期限内的回报。
*点击图片可放大查看
在加快审批上,药监局穷尽了各种手段。一般情况下,新药的审批时间为130个工作日,在《第一批罕见病目录》发布之后,药监局将罕见病药的审批时间压缩到70个工作日以内。
这就像是从绿皮火车直接换乘了高铁。
压缩审批时限,赛诺菲的体会尤其明显。在多发性硬化症纳入《第一批罕见病目录》之后,赛诺菲的治疗药物“奥巴捷”在短短58天内上市,创下了当年中国罕见病用药上市速度之最。
与此同时,药监局还敞开大门,鼓励国外优秀的罕见病用药到中国来上市。
目录出台之后,国家药监局连续发布了3批临床急需新药名单,73个药品当中,罕见病药就有34个,几乎占了一半,而且可以接受境外的数据直接批准上市。
2020年11月,药监局表示:境内未上市的罕见病药品,在满足临床需求的前提下,可以附条件批准上市。
由于罕见病患者人数少,难以开展随机双盲对照试验,国家药监局于2020年8月开始,允许通过国内真实世界临床效果的证据,适当减免临床数据,减少罕见病药品的开发难度。
2022年1月6日,国家药监局药品审评中心发布《罕见疾病药物临床研发技术指导原则》。该原则建议,罕见疾病临床数据可通过疾病自然史研究、公开文献报道、患者登记平台、临床工作人员调研以及患者调查等途径来获得。
根据国家医保局公布的数据,截至2021年12月31日,国内已经获批了60多种罕见病药品。其中据健识局不完全统计,《第一批罕见病目录》发布至今,国家药监局批准上市了至少27个罕见病药品,覆盖了目录中的16个病种。加上治疗如“神经营养性角膜炎”等临床急需的非目录罕见病用药,不到3年时间,药监局已经陆续批准了近30种罕见病药品上市。
药企对于仿制的担忧,国家药监局也给出积极回应,于2018年4月发出《药品试验数据保护实施办法(暂行)》(征求意见稿)称,对罕见病用药或儿童专用药,自该适应症首次在中国获批之日起给予6年数据保护期。
这就打消了企业对于市场竞争的顾虑。
新的期待
借《第一批罕见病目录》的东风和政策利好,今天中国罕见病市场的“热”,已不只停留在概念上了。
外资药企纷纷在中国申报罕见病药物。2018年收购夏尔制药之后,武田成为世界罕见病治疗领域的领头羊,同时积极将一批罕见病用药引入中国。在2021年的医保谈判当中,武田的2款罕见病药品成功纳入医保目录。
武田中国总裁单国洪认为:在中国布局罕见病用药正当其时。
赛诺菲、罗氏、安进等外企也步步紧跟,渤健的“70万一针”的罕见病药纳入医保,受到社会各界关注。
一大批国内企业的研究热情也被带动起来,如曙方医药、德益阳光、琅钰集团、信念医药等等,北海康成更是以“罕见病第一股”的光环成功上市。
2021年10月,中国医药创新促进会政策专委会副主任委员刘军帅在第六届中国医药与创新与投资大会上表示:国内的罕见病市场需求很旺盛,上升趋势很明显。
尽管取得了一定成绩,国家药监局仍旧认为存在相当的挑战。
国内对罕见病的认识水平不够,是影响罕见病药研发的第一个难题。缺少病因、病理的基础研究,就谈不上研发罕见病药物。
除此之外,药审中心也建议企业在研发之初,要开展相应流行病学调研,尽量获得可靠的数据。
罕见病患者登记与流行病学研究方面,中国已启用国家罕见病注册系统,并建立罕见病患者登记制度。首个重症肌无力流行病学调查结果已经公布,溶酶体贮积症筛查项目和首个软骨发育不全队列研究也正式启动。这些工作还任重道远。
至于如何加强对罕见病的基础研究,健识局从2021年中国罕见病大会上了解到,国家药监局明确表示要加强与各部门的联动和配合。
罕见病的特殊性决定了药物研发需要特殊的对待和管理。徐晓强表示:希望能够搭建更多沟通的平台,对药企的罕见病药物研发作好科学引导和帮助。
参考文献
【1】国家药品监督管理局 药品审评中心 唐凌,张杰,艾星,等.罕见病药物研发现状与思考【J】. 中国临床药理学杂志,2021年12月,37(23):3295-3299.
【2】2021年中国罕见病大会 国家药品监督管理局注册司化药处 徐晓强处长 新药管法视角下的罕见病药物监管,2021年12月18日
【3】中国药科大学国家药物政策与医药产业经济研究中心 蒋蓉,邵蓉,美国罕见病药物资格认定管理政策分析及对我国的启示【J】. 中国食品药品监管 2020,4(6):88-93.
【4】军事医学科学院毒物药物研究所 周辛波,孙阳,钟武.关于中国罕见病治疗药物的发展建议【J】 国际药学研究杂志 2017,44(2):85-94.
【5】【美】Philip J. Hilts 保护公众健康【M】北京:中国水利水电出版社. 2014:87-92
【6】贺彩红,张丽雯,阮梅花,等. 罕见病领域研究现状与趋势分析【J】.遗传 2021年6月,43(6):531-544.
【7】牟燕,吴敏,何有琴,等. 基于政策工具视角的我国罕见病领域政策文本分析【J】.中国卫生政策研究 2021年1月,14(1):17-23.
【8】万志前,冉光清. 健康中国背景下孤儿药创新激励的制度安排【J】. 中国新药杂志2020年,29(5):494-499
【9】胡佳佳,论药品实验数据保护的中国方案【J】西南知识产权评论 2021年,第十辑 127-150.
【10】Tony Ellery, Neal Hansen, 药品生命周期管理【M】上海:上海交通大学出版社 2017:25-41
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”