癌症也要有疫苗了?5年随访复发率为0%


独家抢先看
近期,主研 mRNA 技术的 BioNTech 公司在采访中称,基于 mRNA 技术的癌症疫苗可用于治疗癌症,相关药物或将于 2030 年问世 [1]。一时间,令癌症疫苗成为热议话题,甚至冲上微博热搜。
但事实上,癌症疫苗早在五年前就已小获成功——2017 年 7 月,美国和德国的两个团队在同期 Nature 上分别刊载了关于黑色素瘤疫苗的临床研究。尽管双方的试验设计各有不同,但结果却同样令人欣喜。
两篇研究结果均显示:在接受癌症疫苗治疗后,有半数以上的患者肿瘤完全消失;即使有少数患者后期复发,在联合其他免疫治疗后,肿瘤也达到完全消失。甚至在治疗随访 4 年后,患者体内对癌细胞仍然保持着较强的免疫应答。[2-3]
靠疫苗彻底治愈癌症的日子,就要到来了吗?
癌症疫苗,不是预防,而是治疗
这里的癌症疫苗,区别于传统认知中用于疾病预防的疫苗,实际是一种治疗方法,隶属于肿瘤免疫治疗中的一种。根据技术平台的不同,也分为细胞疫苗、核酸疫苗、蛋白多肽疫苗等。
近几年来,肿瘤免疫治疗的好消息不断,在黑色素瘤、非小细胞肺癌、前列腺癌等癌症的治疗中展现了出色的治疗效果,也在 2013 年被 Science 评为年度最重要的科学突破。[4]
图源:参考资料 4
「抗原是癌症疫苗的关键要素之一。理论上,任何实体瘤中,只要有理想的抗原,就可以通过癌症疫苗进行治疗。」从事肿瘤免疫学研究的魏滨(化名)介绍,「尤其是对于预防肿瘤复发及改善长期预后方面,癌症疫苗有着独特的优势。」
2020 年,圣安东尼奥乳腺癌会议上公布了 GP2 癌症疫苗的 Ⅱ 期临床数据:所有手术后接受 GP2 疫苗治疗的 HER2/neu3 阳性乳腺癌患者,5 年随访复发率为 0%。[5]
「癌症疫苗属于主动免疫,有效性长,可以显著延长患者的生存时间。目前大部分研究也都是把生存期作为主要评价指标。」魏滨说,「但由于需要一定时间去诱导免疫应答、激活机体自身免疫反应,在短期疗效上可能略微逊色于其他免疫疗法。」
基于这个特点,癌症疫苗也经常被用于和其他免疫治疗的联合疗法中。
例如 2020 年,知名制药公司 Moderna 公布的一项关于癌症疫苗(mRNA-4157)联合 PD-1(Keytruda) 治疗的临床数据:在 10 例头颈部鳞状细胞癌患者中,总缓解率(ORR)为 50%,中位无进展生存期(mPFS)为 9.8 个月;而在 Keytruda 的单药治疗中,ORR 为 14.6%,mPFS 仅有 2.0 个月。[6]
在肿瘤治疗中,免疫原性高的肿瘤往往被称为热肿瘤,针对这类肿瘤,免疫治疗的效果更好。相应的,缺乏免疫原性的冷肿瘤,往往就是免疫治疗中的难题。而通过癌症疫苗,可以激发自身免疫,将冷肿瘤激发为热肿瘤,取得更好的效果。
前宾夕法尼亚大学医学研究院副教授张洪涛补充道,目前 CAR-T 主要用于血液系统肿瘤治疗,而 PD-1/PD-L1 则只是对热肿瘤的治疗效果较好。「有了癌症疫苗的参与,就可以填补在在冷肿瘤免疫治疗上的缺口。」
3~6 个月,才能找到合适的抗原
尽管效果喜人,但癌症疫苗的研发却困难重重。这主要来自于两方面,一方面在于抗原的选择,另一方面则是所有免疫治疗中都难以避免的免疫抑制。
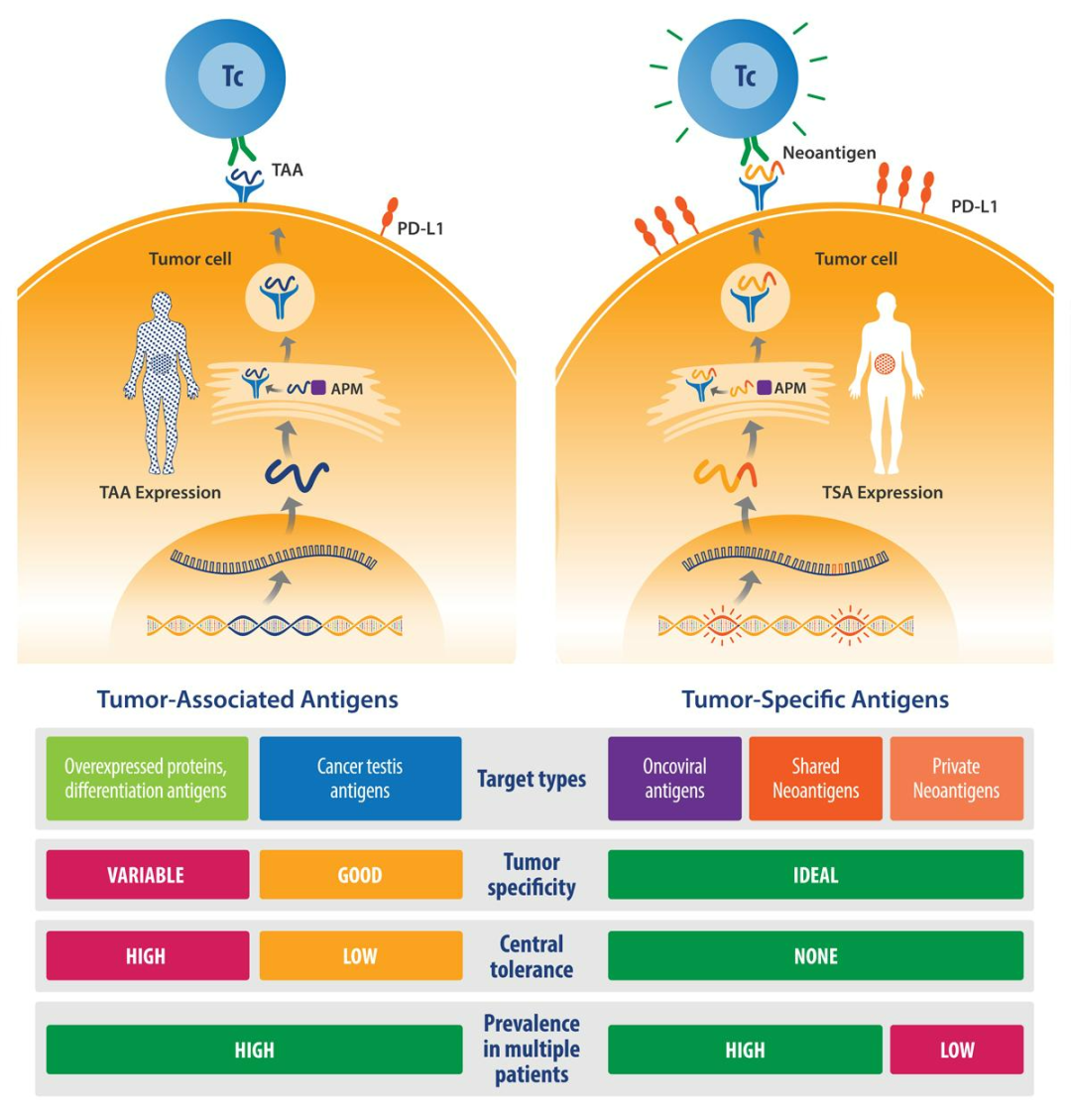
癌症疫苗是利用肿瘤抗原,通过主动免疫激发机体自身的免疫保护机制,从而达到治疗肿瘤或预防肿瘤发生的作用。主要的研究焦点在于找到合适的肿瘤抗原,通常分为两类:一是肿瘤相关抗原(TAA),在肿瘤与健康组织均有表达;二是肿瘤特异性抗原(TSA),仅在肿瘤中表达,具有高度免疫原性。
TAA 与 TSA
图源:参考资料 7
早期许多研究都集中在 TAA ,例如 HER2、CEA、GPC3、MUC1 等靶点。「普遍存在的免疫耐受是早期癌症疫苗研究效果不好的主要原因。此外,由于 TAA 也在正常细胞中有一定的表达,激活的免疫系统也可能会误伤正常细胞。」张洪涛介绍道。
直到癌新抗原(Neoantigen)的发现,才打破这一困局。癌新抗原,顾名思义,是癌细胞发生突变之后产生的新抗原,属于 TSA 的一种。由于癌新抗原只在肿瘤细胞中表达,不仅具有高度的免疫原性,还能避免正常细胞受到损伤。
但像黑色素瘤这样热衷于突变的「热肿瘤」,成百上千的新抗原中只有一小部分能激发特异性免疫反应。如何预测并选择合适的抗原?把整个抗原挑选过程形容成「中彩票」也不为过。
「制备以新抗原为基础的癌症疫苗一般需要这么几个步骤:获取肿瘤组织、测序分析、预测并选择合适的新抗原作为靶点、制备疫苗、最后再进行注射。」
「近几年来,随着测序技术的发展,这方面已经不是难题。主要还是在于寻找抗原。」魏滨介绍道,目前的方法主要是依据计算机或者 AI 测算,但不同的公司有不同的算法和经验,还要分析抗原能否被免疫系统所识别,最终的结果差别会很大。
这也使以新抗原为基础的个性化癌症疫苗需要更多研制时间与投入成本,难以投入到大规模的生产中去。想要制备一剂合适的疫苗,至少需要 3~6 个月的时间,以及数十万的开销。
2010 年,第一个治疗性癌症疫苗 Provenge(sipuleucel -T) 获得美国 FDA 批准,用来治疗难治性前列腺癌。但由于其价格昂贵,一个疗程需要约 10 万美金。加上疗效有限,对比安慰剂只能延长 4 个月的预后 [8],最终也并未获得市场的青睐。
发展迅速,10 年内可用于临床
但仍局限于个性化疗法
近年来,由于 mRNA 疫苗的广泛应用,使得 mRNA 在生产策略、递送系统、抗肿瘤免疫策略等多方面取得进展,也加速了 mRNA 治疗的临床应用 [9]。
2021 年 9 月,波士顿咨询公司发表的一篇研究预测,到 2035 年,mRNA 药物将会达到 230 亿美元市场规模,mRNA 肿瘤治疗性疫苗将分席超 30% [10]。在这样的环境下,BioNTech 做出「癌症疫苗 2030 年问世」的预测也并不算大胆。
「实际上的发展速度可能会更快些。除了有投资、或者说研究风向的影响;另一方面,经验的积累也会加速这个进程。」魏滨认为,癌症疫苗已有十几年的发展,相关技术也趋于成熟。「我们目前看到的『进展』,其实大部分是早期临床试验的结果显现。」
「但目前癌症疫苗的临床试验,主要还是针对晚期癌症患者改善预后的情况。根据癌症疫苗的作用机制,越早应用,可能疗效越好。但想要得到早期的应用效果,还需要大量临床试验的投入。」
而张洪涛则认为,在实际应用中,癌症疫苗可能会受到更多因素的限制。「癌症疫苗并非一种普适的治疗方法。每个患者体内的癌细胞发生的突变都不完全相同,实际应用中需要针对患者个体的癌细胞提取抗原信息,更多还是一种个性化的疗法。」
「用平常的发展眼光看待就好。我们更应该去持续关注、研究新的癌症治疗方法。」在张洪涛看来,十几年的研究积淀下,癌症疫苗的相关技术肯定会越来越成熟。但这并不代表它能够取代其他的癌症治疗手段,也不必过分夸大癌症疫苗的治疗效果。
「毕竟,尽管我们看上去已经有了相当多的治疗方法。但对于癌症这个难题来说,这些解法还是太少太少。」
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”