天价抗癌神药却致癌?CAR-T产品在美遭调查,到底多严重?
凤凰网健康特约作者|张洪涛
11月28日,美国FDA发布公告,声称正在调查CAR-T细胞免疫治疗后出现的T细胞恶性肿瘤的严重风险,涉及已经上市的 6 款 CAR-T产品,分子靶标为BCMA或CD19。类似的4款产品也已在中国获批上市。
CAR-T细胞疗法全称为Chimeric Antigen Receptor T-cell,是一种采集患者的T细胞,通过基因工程将其改造成 CAR-T细胞,以获得精准识别并锁定癌细胞表面特定靶标的技能、从而引导免疫系统攻击和摧毁癌细胞的治疗方法。
由于理念技术身居前沿,对于一些“无药可治”的末期或晚期血液淋巴系统恶性肿瘤效果奇佳,CAR-T又被视为“抗癌神药”。不过在中国,CAR-T为人所知,更多是因为“120万一针”的高昂治疗费。仅仅2021年一年,就有“抗癌药一针120万可清零癌细胞”、“120万一针抗癌神药进入医保谈判”等多个CAR-T话题冲上微博热搜。
要讲CAR-T,就不能不说美国病人艾美丽(Emily Whitehead)。2010年,当时只有5岁大的艾美丽被诊断为白血病(ALL),更不幸的是,治疗并不顺利。在两轮化疗后,因为腿部出现组织坏死,差点儿被截肢;在治疗一年多后,病情复发,再次接受化疗之后,病情也没有缓解,医生甚至已经开始建议进行临终关怀。
但幸运的是,艾美丽的父母没有放弃,让她参加了美国宾夕法尼亚大学医学院一项新的临床试验。当时是2012年,艾美丽7岁。
结果呢?艾美丽如今已经18岁,身体内早已检测不到癌细胞,而且一直都检测不到癌细胞。而对于癌症来说,只要5年内没有复发,就达到了临床治愈的标准,所以,艾美丽的癌症应该说是已经被治愈了。
艾美丽所使用的治疗,就是CAR-T。她参加临床试验所使用的药物,成为全球第一款被批准的CAR-T药物。时间发展到现在,在美国,已经有 6 款 CAR-T 药物获得批准,分别是百时美施贵宝(BMS)的Abecma和Breyanzi,传奇生物和强生共同研发的Carvykti,诺华的Kymriah以及吉利德的Tecartus和Yescarta;在中国,也有复星凯特的奕凯达、药明巨诺的倍诺达、驯鹿生物的福可苏,以及合源生物刚刚获批的源瑞达四款产品获批上市。
图: 2023年的艾美丽。图片来自EmilyWhitehead基金会网站
2023年,已经18岁的艾美丽不但被CAR-T治愈,甚至还考上了宾夕法尼亚大学,开启了全新的人生旅程。但是CAR-T这个明星疗法,却被指出可能导致恶性肿瘤风险——FDA的公告引发极大关注的同时,也让很多人感到迷茫。
那么,FDA为什么发布公告?
CAR-T是一种前所未有的突破性疗法。作为创新药,又涉及基因改造的细胞,在获得批准上市之后,FDA也会对其安全性,尤其对治疗后可能出现的继发性恶性病变进行监测。这种监测时间一般是15年,源于一些比较小概率的不良反应,在临床试验中并不能充分体现,只有在上市、大规模使用之后,才会显示出端倪。
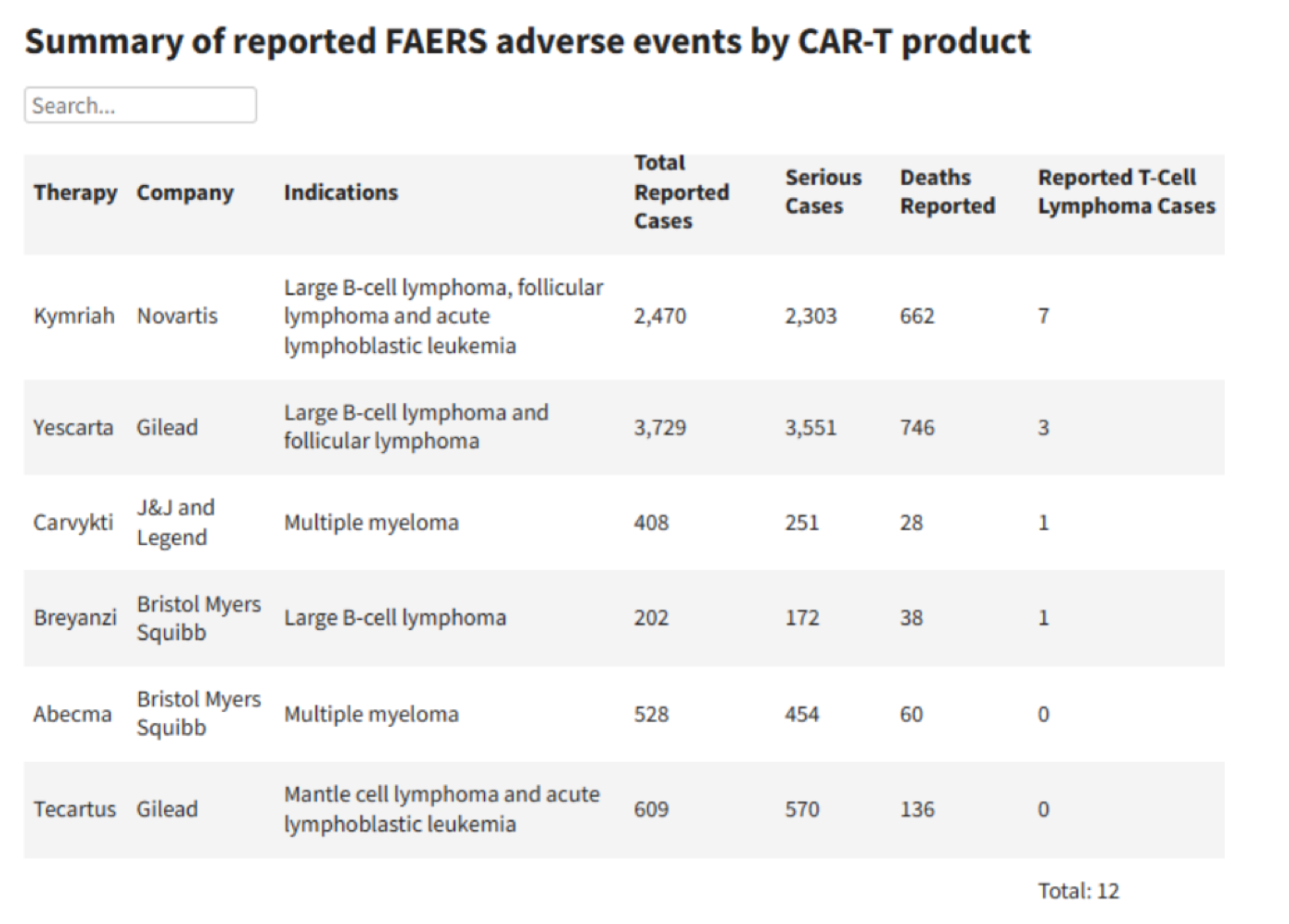
根据FDA所收集的不良事件(AE)数据,有四款CAR-T产品的使用者出现了T细胞恶性肿瘤的报告,其中一些病情严重的患者已经住院,或已经去世。
图:FDA所收集的不良事件(AE)数据表格。图据FDA官网
基于“数据透明”的原则,FDA需要在第一时间将收集到的这些信息公开。这非常重要!因为一般人不具有评判一个药物是否安全有效的知识,也无法掌握比较全面的数据。FDA在了解到药物的有效性和安全性数据之后, 不“藏着掖着”,才会建立起公信力,更好地帮助公众获得对新药的正确认知。
但是,对于FDA所释放的信息,公众也需要客观解读。
比如:CAR-T治疗后出现恶性肿瘤,是否就是CAR-T导致?
首先,从FDA目前所收集到的数据上看,CAR-T治疗后出现继发性恶性肿瘤的概率还是很小的。
比如,对于艾美丽所使用过的第一款CAR-T药物Yescarta,目前收集到3729例不良反应,其中的T细胞淋巴瘤只有3例,比例不到千分之一。
Kymriah使用后出现的病例最多,但比例也不到千分之三。
目前获得批准的CAR-T治疗,主要用于白血病、淋巴瘤、多发性骨髓瘤的治疗。对于这些患者来说,即便没有使用CAR-T治疗,也会有一定比例的T细胞淋巴瘤自然发生,或由其他的治疗方案所诱发产生。如果CAR-T治疗之后患者的生存期得到大大的延长,患者自然发生T细胞淋巴瘤的比例还会更高。
根据传奇生物从多个数据库所收集的数据, 每 100,000 名多发性骨髓瘤患者患者中,T细胞淋巴瘤的发病病例在 0 到 554 之间,即最高可达千分之五。原则上,如果CAR-T治疗之后,T细胞淋巴瘤发病率超过千分之五,才有可能表明这种治疗方式增加了发病风险。
目前传奇生物CAR-T产品相关的T细胞淋巴瘤发病率有多少呢?在所收集到的408个病例中,只有1例T细胞淋巴瘤,发病率不到千分之二。
需要指出的是,不良反应数据库所收集的病例数,并不是一款产品的总使用人数,仅只是部分出现了不良反应的人数。比如吉利德的两款CAR-T产品Tecartus和Yescarta,已有17700名患者使用过,但是数据库中的不良反应总数,只有4338例。
因此,使用CAR-T后T细胞淋巴瘤的发病率,应该低于不良反应数据库所反应出的发病率。
此外,CAR-T是经过改造的T细胞,FDA担心的是这些细胞变成肿瘤细胞的可能性,所以对T细胞淋巴瘤特别关注。 CAR-T细胞真的成为了癌细胞,那么肿瘤细胞就应该是CAR阳性的。但是,根据BMS公司对超过4700名CAR-T产品使用患者的监测, “迄今为止,BMS尚未观察到任何CAR阳性T细胞恶性肿瘤病例”。
由此,我们应该如何看待CAR-T的致癌风险以及其他副作用?
总结一下,FDA所发表的公告,只是一个例行的程序。按照程序,后期会对相关的数据进行评估,以判断所发生的T细胞恶性肿瘤是否与CAR-T治疗有关。
从目前的数据来看,CAR-T治疗导致T细胞恶性肿瘤的可能性如果存在,那也会非常低,几乎可以忽略不计。
正是基于目前公开的数据,专业人士并不担心CAR-T产品的前途。在股市上,相关药企的股价也表现得波澜不惊。
不可否认的是,虽然T细胞恶性肿瘤发生率并不显著,但是CAR-T治疗确实还是有副作用的,这也是公众需要正确了解的。
一款药物获得批准,并不是因为其百分百安全,而是因为其疗效远大于风险。对于像艾美丽这样的患者来说,本来已经无药可救,但是被CAR-T所治愈了,能上大学,这就是一个奇迹。
事实上,CAR-T所面临的真正问题,应该是细胞治疗的成本很高。在美国,一款CAR-T治疗的药物及医疗费用,加在一起要100万至150万美金;在中国,最便宜的CAR-T药物,也需要大约100万人民币。
综上不难看出,对于陷入“审查风波”的CAR-T治疗来说,副作用应该不是问题。而价格太高,患者用不上药物,奇迹不能发生,这可能才是问题。
参考资料:
https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-investigating-serious-risk-t-cell-malignancy-following-bcma-directed-or-cd19-directed-autologous
作者简介:
张洪涛,笔名“一节生姜”。前宾夕法尼亚大学医学院病理及实验医药系研究副教授,研究领域:癌症的靶向治疗以及免疫治疗。著有科普读物《吃什么呢?——舌尖上的思考》、《如果舌尖能思考》。可以谈最前沿的医学研究,也可以讲最通俗的故事。