距离诺奖公布还有一周,减肥“神药”能获奖吗?
距离一年一度的诺贝尔奖公布颁奖名单还有两周时间,今年又将有哪些科学成就的重要贡献者获此殊荣?随着明星减肥疗法Wegovy(司美格鲁肽,semaglutide)、Zepboud(tirzepatide)等的爆炸性影响,推动这类重磅药物问世的科学家成为了瞩目的诺奖候选人。
就在上周,被称为“诺奖风向标”的拉斯克奖(The Lasker Awards)公布了2024年的获奖者,其中临床医学研究奖授予发现和开发GLP-1类疗法的三位科学家:美国麻省总医院的Joel Habener教授、洛克菲勒大学的Svetlana Mojsov博士,以及丹麦诺和诺德的Lotte Bjerre Knudsen博士。GLP-1即胰高血糖素样肽-1,Wegovy的关键成分,以及Zepboud的两个主要成分之一便是模拟GLP-1的GLP-1受体激动剂。
在此之前,同样有“诺奖风向标”之称的加拿大盖尔德纳奖(Canada Gairdner Awards)也在2021年将其国际奖授予了Joel Habener教授,以及加拿大多伦多大学的Daniel Drucker教授、丹麦哥本哈根大学的Jens Juul Holst教授,表彰他们在发现胰高血糖素样肽并阐明其作用机制方面所做的贡献。
正如这些“诺奖风向标”在颁奖词中所说的,GLP-1类药物显著改变了肥胖症治疗的格局,为全球数百万患者提供了新的解决方案,尤其是给靠传统方式如饮食和锻炼未能成功减重的肥胖患者带来了希望。而在变革性的重磅药物背后,则是四十多年来学术界与医药企业数百名科研人员的贡献。
肠道中的新激素
时间回到20世纪70年代末。革命性的重组DNA技术让实验室里的生物学家有了分离基因并研究其功能的好工具。此时刚在麻省总医院建立实验室的内分泌学家Joel Habener博士也开始使用这项技术,研究与糖尿病有关的激素。
糖尿病的特征是血糖水平持续过高,原因在于胰腺不能产生足够的胰岛素,或是细胞难以通过胰岛素从血液中吸收糖。不过,胰腺除了分泌胰岛素外,还分泌一种激素——胰高血糖素。Habener教授和同事们想要分离出编码胰高血糖素的基因,因为这种激素的作用是提高血糖浓度,如果可以阻止它,或许对糖尿病患者有帮助。
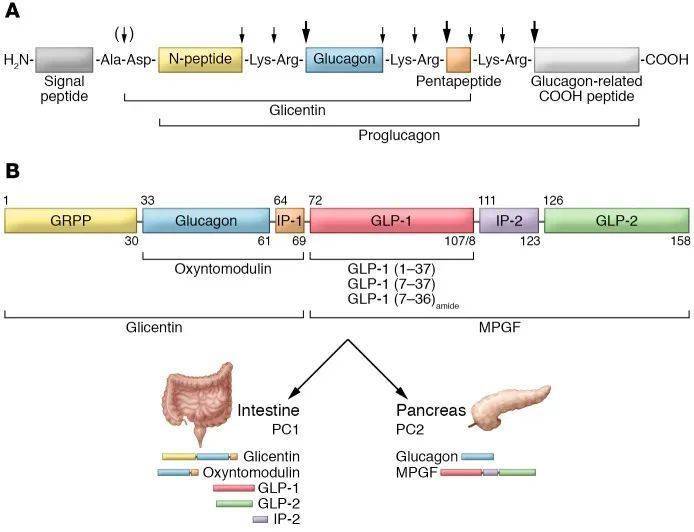
在利用鮟鱇鱼表达重组基因时,他们发现,相关基因编码的氨基酸序列中不仅有胰高血糖素,还嵌入了与胰高血糖素类似的两种新激素,这一结果发表在1982年的一篇论文中。此后不久,对哺乳动物的研究证实了这两种新激素的存在,它们由肠道表达,释放到血液后,会促进胰岛素的分泌,起到降低血糖的效果,因此这两种激素分别被命名为胰高血糖素样肽-1(GLP-1)和胰高血糖素样肽-2(GLP-2)。
而在同一时间段,在丹麦担任胃肠道外科医生的Jens Holst注意到,很多接受了胃切除手术的患者出现了血糖反常的现象:他们在进食后胰岛素水平迅速上升,但血糖水平反而骤降。这让他推测,肠道可能生成了某种物质,功能与胰高血糖素类似,可以起到平衡血糖的作用。当他在人体血液中找到这样的分子后,将其称为肠高血糖素(enteroglucagon)——正是大洋彼岸发现的GLP-1。
▲鮟鱇鱼(A)和人体(B)编码胰高血糖素及GLP的DNA片段示意图(图片来源:参考资料[5])
哺乳动物的GLP-1由37个氨基酸构成,不过序列完整的多肽并没有生物活性。生物化学家Svetlana Mojsov博士鉴定并纯化了GLP-1的生理活性形式。
Mojsov博士曾在著名化学家、1984年诺贝尔化学奖得主Bruce Merrifield的实验室工作,开发了创新的研究方法和试剂用于多肽的合成。80年代,她作为多肽合成专家来到麻省总医院,为那里的其他科学家合成多肽。与此同时,新出现的神秘肽GLP-1吸引了她的注意。
根据氨基酸的特征,她推测从第7个氨基酸开始的31个氨基酸片段,即GLP-1(7-37)可以和胰高血糖素家族成员完美匹配,并通过制作针对GLP-1不同片段的抗体进行检验。在大鼠的肠道内,她发现了符合推测的GLP-1活性形式。1986年,她与Habener教授合作发表了他们的发现。
在这段时间,来到Habener的实验室做博士后的Daniel Drucker加入了对GLP-1的研究。使用Mojsov博士合成的GLP-1,Drucker博士和同事们通过实验证明,GLP-1确实可以促进大鼠胰岛细胞分泌胰岛素。在此后持续多年的研究中,Drucker领导的一系列工作还发现,GLP-1的作用位点不仅在胰腺,还会在包括大脑、胃、心脏、血管和免疫系统在内的众多器官、系统中发挥作用。其中,GLP-1对大脑的作用机制后来催生了新型减肥药的诞生。
糖尿病的新疗法
不过在90年代,当GLP-1作用于胰腺的机制开始清晰时,研究人员率先想到的是治疗糖尿病:给2型糖尿病患者注射GLP-1,是不是就可以帮助患者降低胰高血糖素水平、促进胰岛素的释放,从而稳定血糖?
虽然很快就有了概念验证,但研究人员随即发现了问题:GLP-1在体内的寿命太短了,血液中的酶在几分钟内就会把GLP-1降解掉。而且加大剂量也不行,因为这会引起恶心和呕吐。
长期研究GLP-1的Holst团队想到了一种解决方案:他们找出了在体内降解GLP-1的酶DPP-4。通过抑制DPP-4,可以使GLP-1维持更长的时间。有趣的是,由于DPP-4也是降解GLP-2的酶,因此DPP-4抑制剂也可以让GLP-2维持更长时间。这意味着,人体自身产生的两种胰高血糖素样肽都可以在体内更长久地发挥作用,有效降低血糖。这种策略在2006年正式造福患者:首款DPP-4抑制剂疗法通过FDA的批准正式上市,用于治疗2型糖尿病。
另一种让GLP-1发挥作用的思路是,改造出一个比天然版本更稳定的版本,这也带来了它的新作用——治疗肥胖与超重。
挖掘减肥潜力
基于GLP-1在降血糖与促进胰岛素释放方面的卓越表现,诺和诺德、礼来等药物研发公司也嗅到了GLP-1所蕴藏的巨大应用价值。数年后,诺和诺德的科学顾问Lotte Bjerre Knudsen博士看到了一篇具有转折意义的论文,也由此开启了GLP-1减肥疗法研发的新篇章。当时,来自英国汉姆史密斯医院(Hammersmith Hospital)的Stephen Bloom博士报道称,将GLP-1注射到大鼠的脑部,可以显著抑制大鼠的食欲、减少食物摄入量。
那时,一种新兴的观点逐渐涌现,即针对某一疾病的分子也可能对其他疾病有效。是否存在一种可能,GLP-1既能帮助对抗糖尿病,也能用于治疗肥胖症?带着这个疑问,Knudsen博士开始着手挖掘GLP-1的另一种潜在作用。
同样地,Knudsen博士也需要解决GLP-1进入体内失效过快的问题,如果不绕开DPP4酶的分解,GLP-1通常就能存在几分钟,这点时间想要发挥药效简直是天方夜谭。Knudsen博士想要通过一种手段来避免GLP-1的快速失活,至少让它能保持24小时的活性。
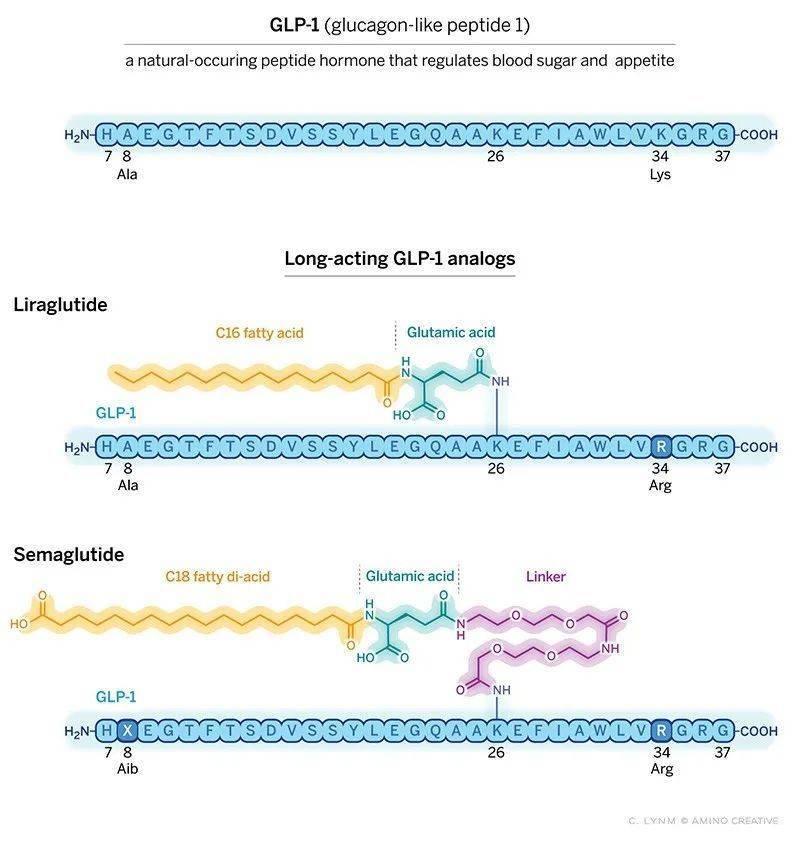
她发现,脂肪酸似乎可以承担这一重任。当脂肪酸与GLP-1结合时,前者可以携带整个分子附着在血液中的白蛋白上,白蛋白不仅含量丰富,还能随血液循环遍及全身。如此一来GLP-1不再会被DPP4降解,也难以被肾脏过滤。而在到达靶细胞所在区域后,脂肪酸会逐渐释放GLP-1,让其与细胞表面受体结合发挥作用。
这一思路催生了新一代减肥药的诞生。Knudsen博士设计了GLP-1的类似物,同时测试了不同脂肪酸的结合效果,包括脂肪酸的长度、类型,与GLP-1的结合位点和化学接头,研究团队想尽最大程度延长GLP-1类似物在体内的寿命,并模拟GLP-1的氨基酸序列,减少自体免疫反应。
在无数的尝试与更新后,一种名为利拉鲁肽(liraglutide)的候选药物出现了,它也不负众望,展现出了惊人的应用价值。在2010年的一项临床试验中,利拉鲁肽有效地帮助糖尿病患者控制了血糖水平,改善了糖尿病症状。欧洲药品管理局(EMA)与美国食品药品监督管理局(FDA)先后批准利拉鲁肽用于糖尿病治疗。
除此之外,Knudsen博士还在未患有糖尿病的肥胖、超重人群中测试了利拉鲁肽的作用,她发现利拉鲁肽不仅会让受试者产生饱腹感,还可以让使用者在一年的时间中平均减重12磅(约5.44千克),三分之一的受试者减掉了至少5%的体重。EMA与FDA也分别于2014、2015年为其大开绿灯,批准其用于治疗肥胖症。
Knudsen博士并未满足于此,利拉鲁肽的药效可以维持一天,因此需每天注射。她为自己制定了一个新目标:让GLP-1疗法实现一周注射一次。她和同事改变了GLP-1中的一个氨基酸,让其具有更强的DPP4抗性,同时测试了脂肪酸和化学连接的组合,让GLP-1能更好地释放出去。这些变化让新分子可以存在更久的时间,同时在靶细胞上让GLP-1更高效地与受体结合。
基于此,全新的GLP-1类似物分子出现了,即我们耳熟能详的司美格鲁肽,它的半衰期提升至了165小时,并且减重效果远超利拉鲁肽,16个月能让使用者减重28磅(约12.7千克)。FDA已经分别于2017年和2021年批准司美格鲁肽用于治疗糖尿病与肥胖症。
▲利拉鲁肽和司美格鲁肽的分子示意图(图片来源:参考资料[2])
除了诺和诺德,礼来的新一代GLP-1减肥疗法也正在路上。比如礼来研发的tirzepatide在GLP-1的基础上额外携带了一个名为葡萄糖依赖性促胰岛素多肽(GIP)的部分,可以作用于双靶点,共同发挥减重效果。这还不够,礼来还推出了另一种名为“三重G”分子,除了GLP-1、GIP,研究者还添加了胰高血糖素(glucagon),在临床试验中,这种“三重G分子”可以让受试者减重达20%,也势必在未来掀起另一场减肥热潮。
在减肥之外……
除了糖尿病与肥胖症,以司美格鲁肽为代表的GLP-1受体激动剂(GLP-1RA)也正给其他疾病治疗带来全新力量。今年5月,《美国医学会杂志》(JAMA)子刊JAMA Network Open的一项研究表明,相较于胰岛素治疗,接受GLP-1RA治疗的糖尿病患者患有肥胖相关癌症的风险要更低,包括胆囊癌、胰腺癌、结直肠癌等类型。
此外,司美格鲁肽还可能潜在地帮助个体预防神经退行性疾病。一些临床前研究发现司美格鲁肽对以β淀粉样蛋白(Aβ)处理的SH-SY5Y神经母细胞瘤细胞具有保护作用,其可增加Aβ处理细胞的存活率;而2型糖尿病患者在接受司美格鲁肽治疗后,患有痴呆症的风险要更低;另外,司美格鲁肽还有助于改善帕金森病模型小鼠的症状,保护黑质和纹状体中的多巴胺能神经元。
相关阅读:除了减重与糖尿病,司美格鲁肽还可能治疗阿尔茨海默病、帕金森病?
目前,FDA已经批准司美格鲁肽用于降低患有心血管疾病且超重或肥胖个体的心脏病发作、卒中风险。在未来,司美格鲁肽等GLP-1RA类药物还能带来多少的深远影响呢?我们也可以拭目以待。
参考资料:
[1]GLP-1-based therapy for obesity.Retrieved Sep.20,2024 from https://laskerfoundation.org/winners/glp-1-based-therapy-for-obesity/
[2]Canada Gairdner Awards 2021 Laureates,Retrieved October 4,2021,from https://gairdner.org/winners/current-winners/#Jens_Juul_Holst
[3]Her work paved the way for blockbuster obesity drugs.Now,she’s fighting for recognition.Retrieved Sep.20,2024 from https://www.science.org/content/article/her-work-paved-way-blockbuster-obesity-drugs-now-she-s-fighting-recognition
[4]Jens Juul Holst et al.,(2016)Mechanisms of surgical control of type 2 diabetes:GLP-1 is key factor.Surgery for Obesity and Related Diseases,Doi:DOI:10.1016/j.soard.2016.02.033
[5]Daniel J Drucker et al.,(2017)Discovery,characterization,and clinical development of the glucagon-like peptides.J Clin Invest.doi:10.1172/JCI97233