重磅!中国团队研究登上《柳叶刀》,院士:未来将改写全球指南


独家抢先看
冠心病患者,到底什么时候需要放支架?
当地时间 2025 年 3 月 30 日,第 74 届美国心脏病学会年度科学会议(ACC.25)上,中国科学院院士、浙江大学医学院附属第二医院王建安代表团队公布了一项突破性的研究成果——FLAVOUR II 研究。
这项研究同步发表于国际顶刊 The Lancet。聚焦于冠脉狭窄 ≥50% 的冠心病患者,在进行经皮冠状动脉介入治疗(PCI)时,究竟哪一种策略更有优势。
「我相信,这个研究结果也会进一步改变我们全球的临床指南。」王建安院士这样说。
传统有创检测,能被替代吗?
冠心病是由冠状动脉狭窄或由动脉粥样硬化导致阻塞引起的心肌缺血和心绞痛或心肌梗塞性心脏病的一种形式,是目前全球范围内威胁人类健康的主要疾病之一。
在冠心病患者的介入治疗中,一大重点在于,如何准确评估冠状动脉狭窄是否引起心肌缺血——也就是「功能意义」。
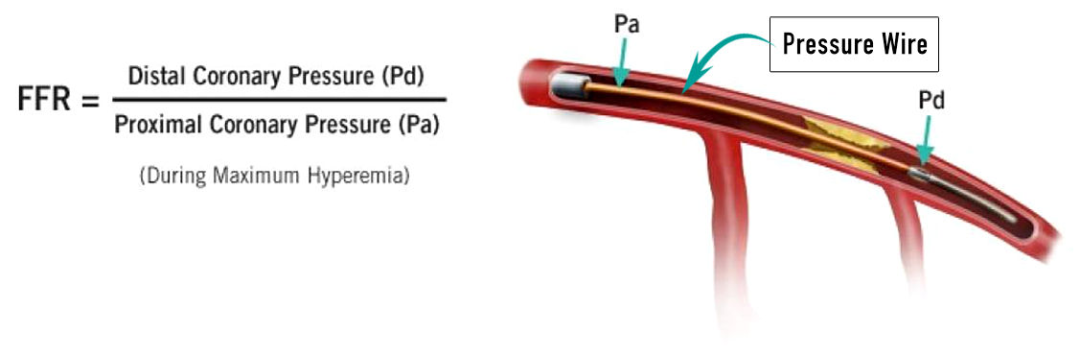
冠状动脉血流储备分数(fractional flow reserve,FFR)是评估冠状动脉血流的重要功能学和生理学指标,定义为存在狭窄病变情况下,该冠状动脉提供给心肌的最大血流量与理论上无狭窄情况下心肌所能获得最大血流量的比值。
目前,FFR 已经成为了诊断冠状动脉病变严重程度的「金标准」。然而,传统 FFR 的测量需要使用血管扩张药物进行血管预处理,还需要放置冠状动脉压力导丝、检查操作时间长。种种因素,给 FFR 的临床应用带来了不少难题。
FFR 示意图
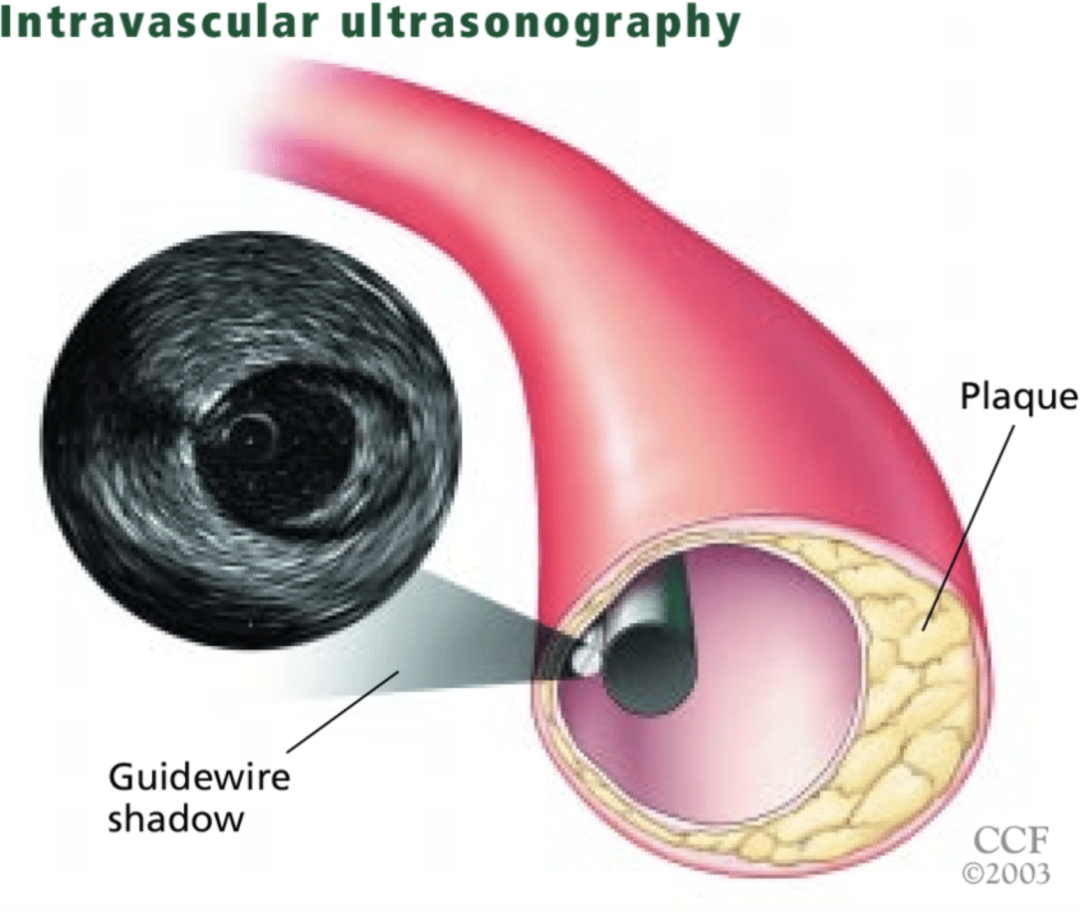
另一方面,血管内超声(IVUS)同样是指导介入治疗的重要工具。
这是一种将微型超声探头通过导管送入冠状动脉内,实时获取血管横截面影像的介入诊断技术。IVUS 结合了无创超声和有创导管技术,提供血管壁结构、斑块性质及狭窄程度的精准评估,是冠心病精准诊疗的重要工具。
近年来,多项国内外指南推荐,适宜患者可应用 IVUS 来指导优化置入支架。IVUS 对造影显示比较模糊的病变、非阻塞性冠状动脉心肌梗死或自发性冠状动脉夹层的鉴别诊断均有一定的诊断意义,有助于确定罪犯血管的位置及性质,从而有利于确定进行 PCI 治疗还是药物保守治疗。
但同样的,IVUS 也是一项有创操作,且由于培训不足或经验欠佳等因素,在临床工作中,仍存在使用不规范、对复杂病变评估不准确等现象,影响 PCI 治疗的总体效果。
IVUS 示意图
那么,是否有更简便、无创的方式?
近年来,随着影像学技术的发展,基于血管造影的无创 FFR 技术应运而生。
这是一种基于冠状动脉造影影像数据,通过计算机流体力学(CFD)或人工智能算法模拟血流动力学参数,计算冠脉狭窄对远端血流的影响,帮助判断是否需要介入治疗。
在临床介入治疗的决策中,血管造影衍生的 FFR 已获得欧洲心脏病学会 1B 类推荐,显示出优于单纯血管造影的评估。同时,还可提供对疾病模式的术前生理学评估和 PCI 术后的生理学评估。
但是,血管造影衍生的 FFR,到底能否完全替代有创检测?最新公布的 FLAVOUR II 研究,正是为了探索这一问题的答案。
中国院士团队最新研究:或将改写国际指南
FLAVOUR II 是一项开放标签、多中心、随机、非劣效性试验,在中国 22 家中心开展,全称为:血管造影衍生的 FFR 与 IVUS 引导的干预策略对冠状动脉疾病患者临床结局的比较研究。
此前的 FLAVOUR 研究发现,对于冠状动脉中度狭窄的患者,FFR 指导 PCI 治疗在术后 24 个月的全因死亡、心肌梗死及再次血运重建的复合终点事件结局上不劣于 IVUS 指导 PCI 治疗,且 FFR 指导 PCI 与较低的支架植入率相关。
而 FLAVOUR II 研究旨在对比,血管造影衍生的 FFR 和 IVUS 相比,在判断患者是否需要介入治疗时,孰优孰劣——即患者临床结局究竟有何差异。
2020 年 5 月 29 日至 2023 年 9 月 20 日期间,共筛查了 4417 人,其中 1872 例患者成功入组。33 名患者自愿或被医生退出后,剩余 1839 名患者中的 923 名被随机分配到血管造影衍生的 FFR 组,916 名被随机分配到 IVUS 组。
1839 例患者,心外膜冠状动脉经血管造影目测评估存在至少 50% 狭窄且血管直径 ≥2.5mm。其中,736 例(40.0%)为慢性冠状动脉综合征,1087 例(59.1%)为急性冠状动脉综合征。患者的中位年龄为 66.0 岁;1839 例患者中有 1248 例(67.9%)为男性,591 例(32.1%)为女性。
在整个试验期间,血管造影 FFR 组 990 条靶血管中有 688 条(69.5%)进行了血运重建,血管内超声组 984 条靶血管中有 797 条(81.0%)进行了血运重建。
研究的主要终点是随机分组后 12 个月内以患者为中心的复合终点,包括死亡、心肌梗死或任何血运重建。次要终点是 24 个月和 60 个月时的以患者为中心的复合终点、靶血管衰竭(定义为心源性死亡、靶血管心肌梗死或靶血管血运重建的复合终点)、成本效益分析、全因死亡、心源性死亡等等。
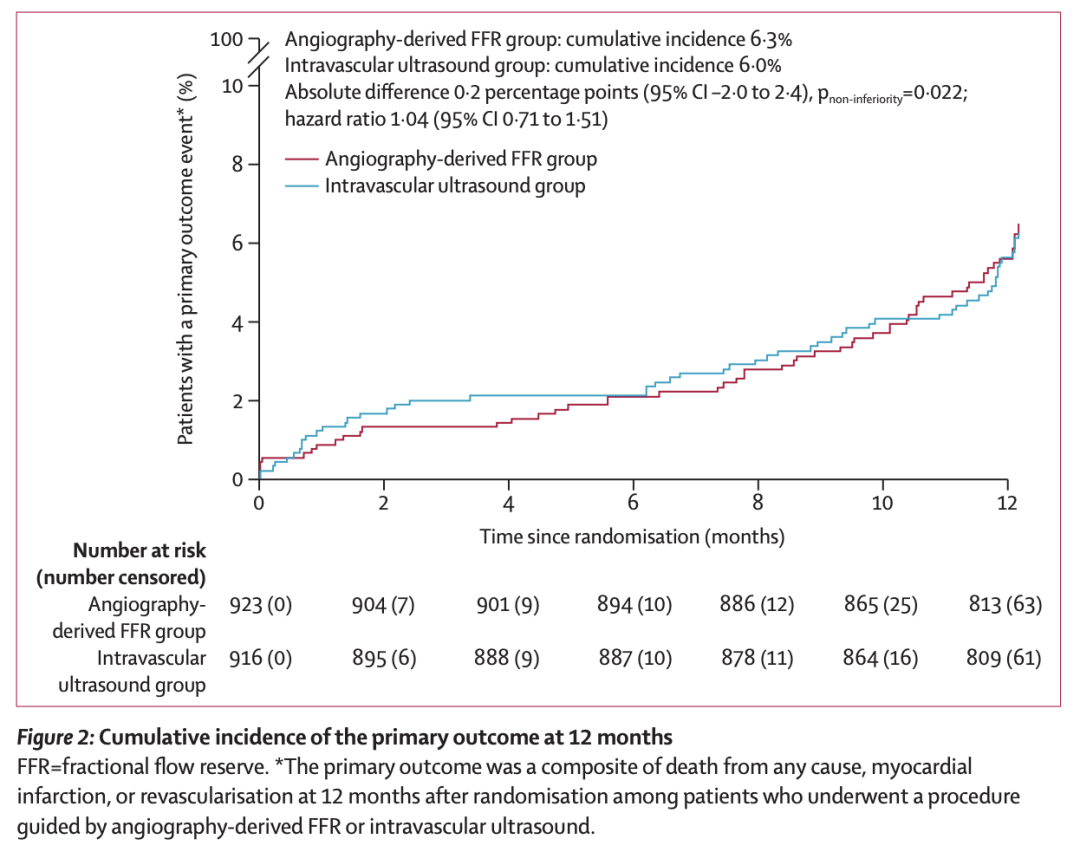
主要结局的 12 个月累计发生率
结果显示,血管造影 FFR 组有 56 名患者、IVUS 组有 54 名患者发生了主要结局事件(6.3% vs 6.0%,绝对差异 0.2 个百分点 [单侧 97.5% CI 上限 2.4],p非劣效性=0.022;风险比 1.04 [95% CI 0.71 至 1.51])。
血管造影 FFR 组死亡率为 1.8%,IVUS 组为 1.3%,统计学上无差异(绝对差异 0.4 个百分点 [95% CI –0.7 至 1.6];风险比 1.34 [0.63 至 2.83],p=0.45)。
此外,两组的复发性心绞痛发生率均较低:血管造影 FFR 组 923 名患者中 26 名复发性心绞痛(2.8%),IVUS 组 916 名患者中 35 名复发性心绞痛(3.8%)。
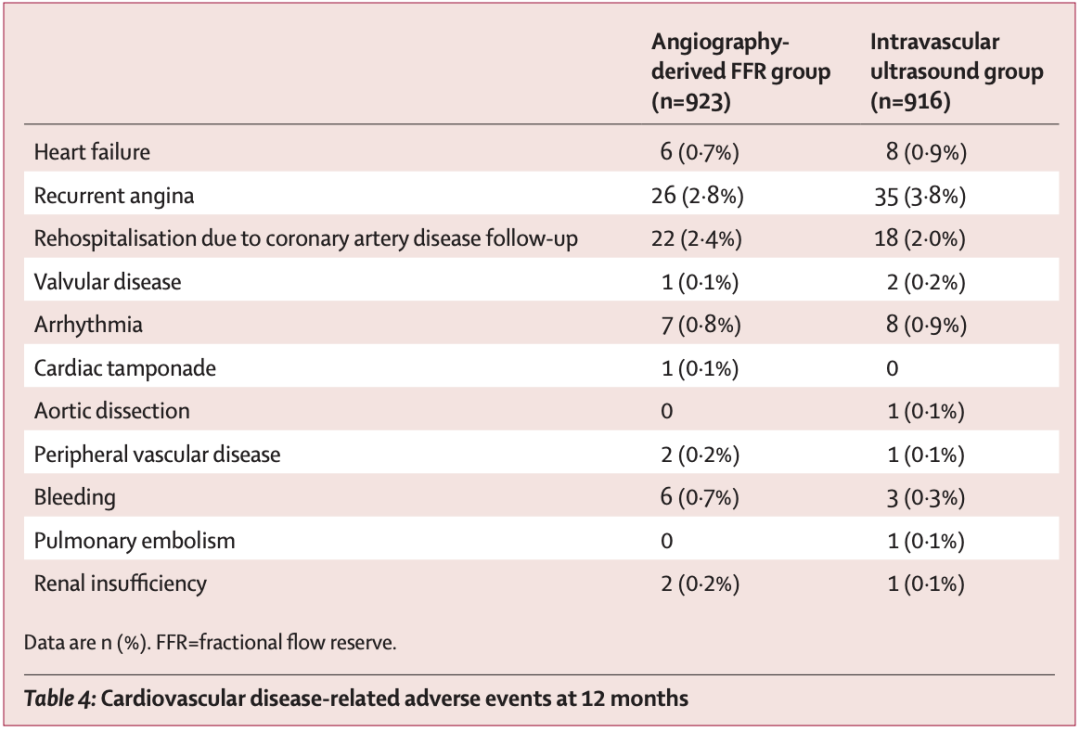
12 个月时心血管疾病相关不良事件
由于随访时间不足,未报告随机分组后 24 个月和 60 个月的死亡、心肌梗死或血运重建的综合结果。但是,其他主要和次要结果已得到充分报告。
综上,研究认为,血管造影衍生的 FFR 引导综合 PCI 策略(包括血管重建决策和支架优化)不逊于 IVUS 引导。
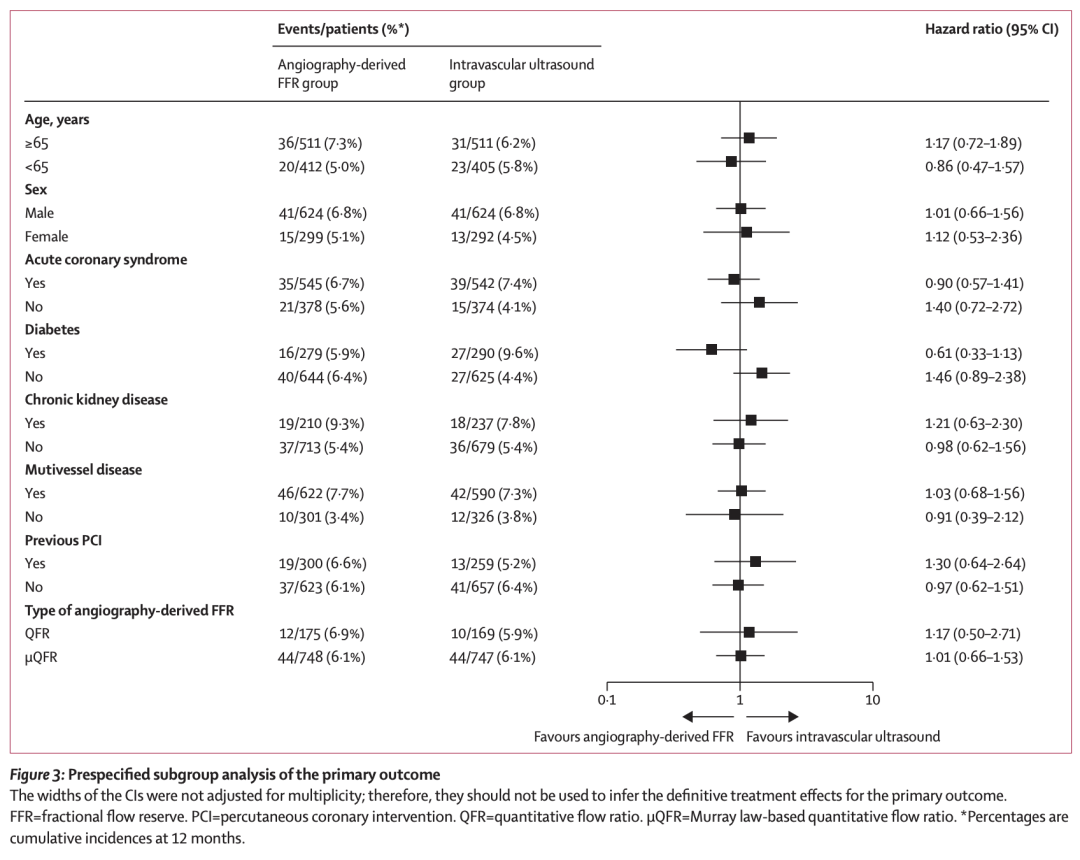
主要结局的预设亚组分析
这一发现不仅为临床医生提供了一种更为简便、无创的 PCI 决策和优化工具,也将为未来国内外指南的制定产生深远影响。
王建安院士指出,血管造影衍生的 FFR 的一大优势在于,在常规造影的基础上,通过计算就能准确地把握患者是否需要 PCI 治疗。「它的计算速度很快,操作者之间的重复性也非常好。」
「我相信未来这种血管造影衍生的 FFR,在不远的将来将会替代有创导丝测量的 FFR。」王建安院士表示,在目前的 1 年随访基础上,接下来团队还将进行 2 年、5 年甚至 10 年的随访研究。
与此同时,团队已经启动了 FLAVOUR III 研究,在此基础上进一步探索 血管造影衍生 FFR 和 IVUS 联合使用的可能性。
「把生理学参数和影像学参数结合起来,再和有创的 FFR 对比孰优孰劣。目前已有 1/4 以上的病人完成入组。」王建安院士说。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”