超1400万一针!这款新药拟纳入优先审评


独家抢先看
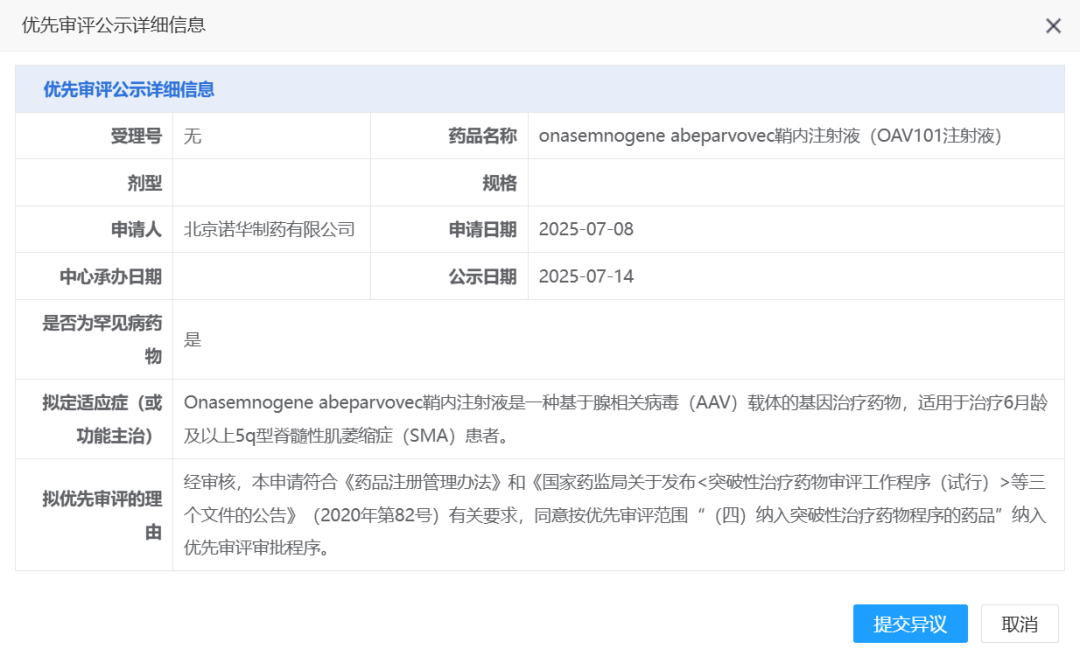
7 月 14 日,CDE 官网显示,诺华 Onasemnogene abeparvovec 鞘内注射液(OAV101 注射液,Zolgensma)拟纳入优先审评,这是一种基于腺相关病毒(AAV)载体的基因治疗药物,适用于治疗 6 月龄及以上 5q 型脊髓性肌萎缩症(SMA)患者。
Zolgensma 是一款针对 SMA 的基因疗法,通过单次静脉注射即可实现持续的 SMN 蛋白表达,从而阻止疾病进展。这是诺华在 2018 年以 87 亿美元收购 AveXis 公司获得的产品,在 2019 年 5 月首次获 FDA 获批上市,用于两岁以下 I 型 SMA 患者。
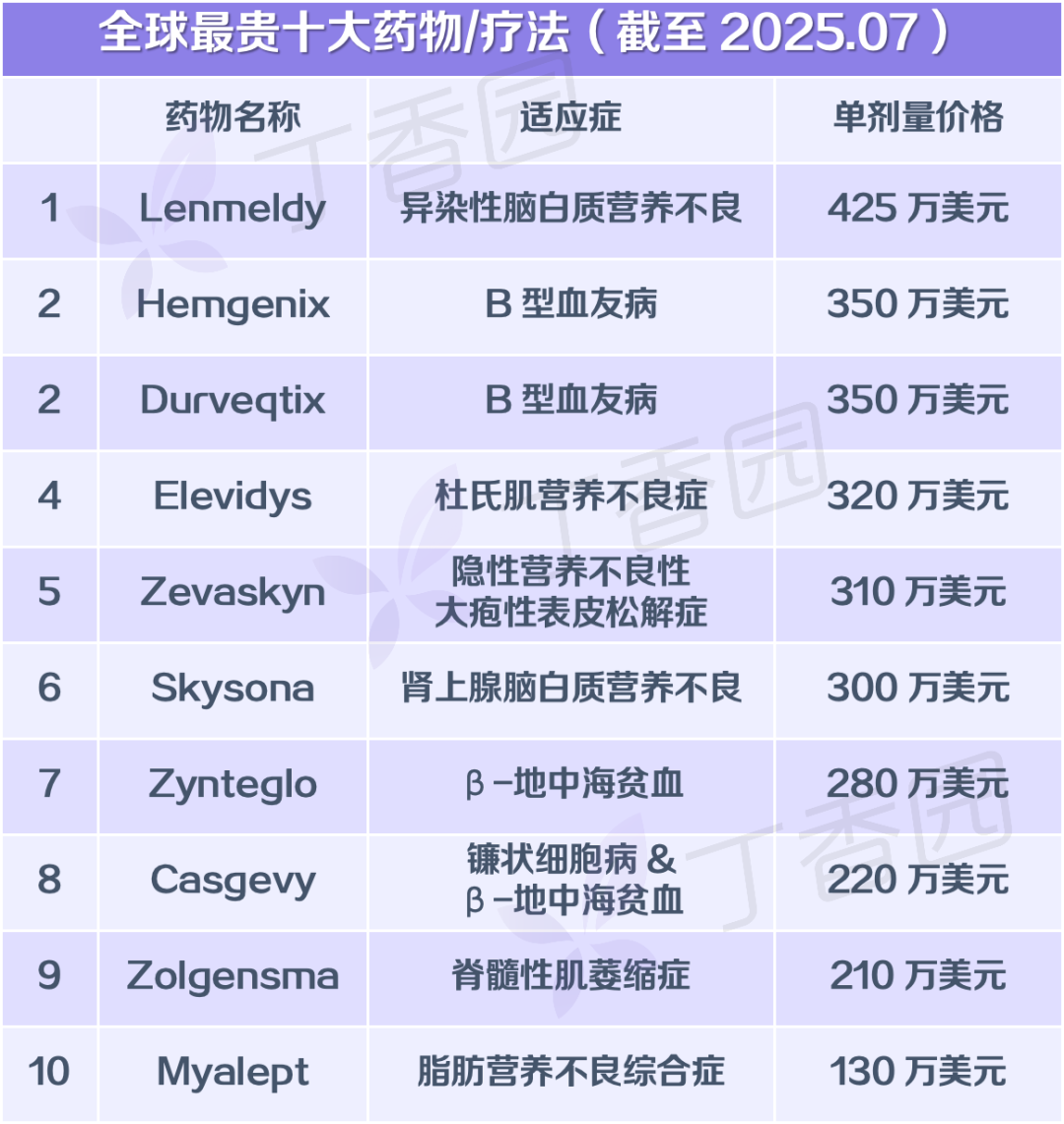
此前诺华披露,其针对 Zolgensma 研发的总投入达到了 94 亿美元(约合人民币 669 亿元),研发成本巨大。相对的,Zolgensma 的定价也并不便宜,以每剂 210 万美元(约合人民币 1495 万元)的价格上榜「全球十大最贵药物」,位列第 9。
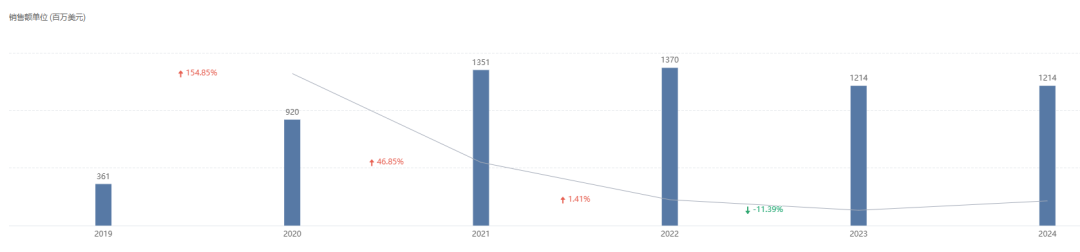
从销售额角度来看,Zolgensma 上市后第一季度销售额就达到了 1.6 亿美元,2021 年销售额高达 13.51 亿美元,2022 年销售额进一步上涨到 13.7 亿美元,2024 年销售额为 12.14 亿美元。
丁香园 Insight 数据库显示,22 年 4 月,Zolgensma 首次在国内启动临床。这是一项随机、假操作对照、双盲、III 期临床试验,属于全球 III 期临床 STEER 研究(NCT05089656)的中国部分,针对 2 - 18 岁初治 2 型 SMA 患者,拟在中国入组 20 人,国际入组 125 人。
24 年 12 月,诺华宣布 STEER 研究达到主要终点。根据诺华新闻稿,这是首个在两岁及以上未接受治疗的 SMA 患者中具有临床获益的试验性基因疗法。
研究结果显示,相较于对照组,接受鞘内注射 Zolgensma 治疗的 SMA 患者的 Hammersmith 运动功能量表扩展版(HFMSE)总分较基线有所增加,这表明 SMA 患者的运动功能得到改善。详细数据将在 2025 年即将举行的医学会议上公布。
在安全性方面,Zolgensma 的安全性良好,两组之间的总体不良事件和严重不良事件相似。最常见的不良事件是上呼吸道感染、发热和呕吐。
丁香园 Insight 数据库显示,目前全球范围范围内,SMA 新药仅获批 3 款,分别是 PTC Therapeutics 的利司扑兰、Ionis Pharmaceuticals 的诺西那生和诺华的 Zolgensma。值得一提的是,其余 2 款均为化药,仅诺华 1 款为基因治疗药物。
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”