中国首创,「稻米造血」获批上市


独家抢先看
7 月 18 日,NMPA 官网显示,禾元生物申报的植物源重组人血清白蛋白(HY1001)获批上市,用于肝硬化低白蛋白血症(≤30g/L)的治疗。此前已于 2024 年 8 月被 CDE 纳入优先审评。
图片来源:NMPA 官网
目前,临床使用的人血清白蛋白药物均来自人类血浆的分离提取,存在资源短缺和病原体传播的风险。据统公开资料显示,2020 年国内人血清白蛋白治疗药物市场规模已高达 258 亿元人民币,且进口依赖严重,进口产品长期占据 60% 以上的市场,人血清白蛋白仍存在较大供需缺口。
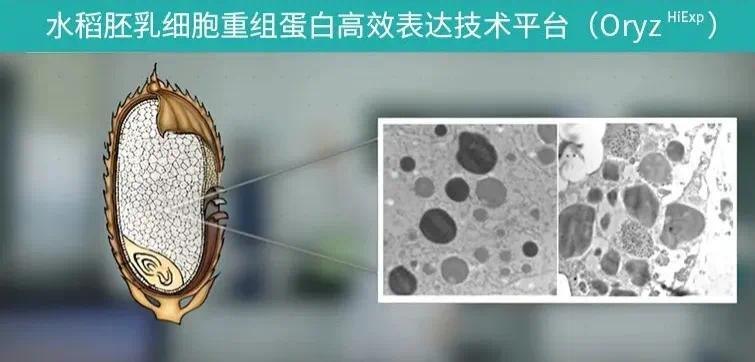
HY1001 是禾元生物首个研发的重磅产品,利用水稻胚乳细胞表达,经提取、纯化的重组人血清白蛋白产品,成功解决了重组人血清白蛋白的纯度、规模化和成本问题,更实现了从源头上杜绝病毒传播的风险,确保了血液制品的安全性。
图片来源:企业官微
该项目还获得了国家「重大新药创制」科技重大专项的支持,专家组评价「该技术是一项原始创新技术,具有广泛的应用前景,为医药生产开辟了一条新途径」。
此次 HY1001 的获批,标志着禾元生物在全球首创的植物重组蛋白质药物领域取得了显著进展,有望解决我国人血清白蛋白长期依赖进口的局面。
2025 年 6 月,禾元生物一项关于 HY1001 的临床研究在《Gut》上发表。这是一项多中心、随机双盲、阳性对照(基立福的 Albutein)的 II 期研究,按照中国 CDE 和美国 FDA 共同认可的临床方案进行,对 220 例肝硬化腹水患者进行静脉注射给药,每日剂量高达 20g,连续注射最长 14 天。
研究结果显示,HY1001 能显著提升白蛋白水平,14 天内血清白蛋白浓度达到 35g/L 的受试者比例非劣效于阳性对照组,且升高胶体渗透压、达标中位时间、血清白蛋白变化值、体重腹围改善等与阳性对照无统计学差异;未发生药物相关严重不良反应,安全性良好;没有产生有临床意义的抗药抗体和抗 HCP 抗体,宿主蛋白免疫原性低。
2024 年 11 月,禾元生物宣布 HY1001 在肝硬化低白蛋白血症患者中的 III 期头对头血浆来源人血清白蛋白的临床(CTR20230244)达到研究终点。数据显示,HY1001 的疗效不劣于对照人血清白蛋白,且安全性良好。
2024 年 9 月,贝达药业和禾元生物就 HY1001 签署药品区域经销协议。贝达药业获得在约定区域内独家经销 HY1001 的权利。
丁香园 Insight 数据库显示,除了 HY1001,禾元生物还有 5 款产品进入临床阶段(含批准临床)。
编辑:ccai
“特别声明:以上作品内容(包括在内的视频、图片或音频)为凤凰网旗下自媒体平台“大风号”用户上传并发布,本平台仅提供信息存储空间服务。
Notice: The content above (including the videos, pictures and audios if any) is uploaded and posted by the user of Dafeng Hao, which is a social media platform and merely provides information storage space services.”